| IV. Die Hauptsätze der Thermodynamik UNI ULM |
|
= Gesetz des thermischen Gleichgewichts |
Der 0. Hauptsatz wurde erst nach den anderen dreien
entdeckt. Da er aber grundlegend für die Thermodynamik und
die anderen Hauptsätze ist, wurde er an den Anfang gestellt.
Damit man die Bezeichnungen für die anderen, bereits
zugeordneten Hauptsätze nicht mehr ändern muß, wurde er
einfach mit der 0 betitelt.
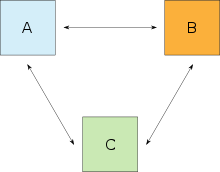
Der 0. Hauptsatz macht folgende Aussage: Es steht das System A mit dem System B in thermischem Gleichgewicht. Das System B steht auch mit System C im thermischen Gleichgewicht. Daraus folgt, daß auch die beiden Systeme A und C miteinander im thermischen Gleichgewicht stehen müssen: Man kann also folglich drei Zustände durch zwei Sätze beschreiben. |
| IV. Die Hauptsätze der Thermodynamik | ||||||||||||||
|
||||||||||||||
= Energieerhaltungssatz der Thermodynamik |
||||||||||||||
Der 1. Hauptsatz der Thermodynamik ist eine besondere Form
des Energieerhaltungssatzes
der Mechanik. Er sagt aus, daß Energien ineinander
umwandelbar sind, aber nicht gebildet, bzw. vernichtet
werden können. Er lautet für den Übergang eines geschlossenen
Systems vom Zustand A nach B:
In Worten bedeutet dies: Die Änderung der inneren Energie eines geschlossenen Systems ist gleich der Summe der Änderung der Wärme und der Änderung der Arbeit. Das bedeutet, daß die innere Energie in einem geschlossenen System konstant ist. Dabei wird am System verrichtete Arbeit, bzw. zugegebene Wärmemenge mit einem positiven Vorzeichen versehen und vom System verrichtete Arbeit bzw. abgegebene Wärmemenge mit einem Negativen. Die gesamte Energiemenge in einem System, das von einem Zustand A in den Zustand B übergegangen ist, ist folglich die Summe der als Wärme und Arbeit zugeführten Energien. Diese Gesamtenergiemenge ist die innere Energie U. Für ihren Zahlenwert ist es egal, ob Wärme oder Arbeit zugeführt wurde. Sie ist somit unabhängig vom Weg und folglich eine Zustandsgröße. Betrachtet man ein isoliertes System, kann weder Wärme noch Arbeit oder sonst eine Energie entweichen. Energie kann weder erzeugt noch zerstört werden. Eine Veränderung in einem isolierten System kann demnach weder zu einer Zunahme noch zu einer Abnahme der inneren Energie, sondern nur zu einer Umverteilung der Energiemenge zwischen den unterschiedlichen Formen, führen. Bei geschlossenen Systemen gilt dies dann, wenn man die Umgebung des Systems in die Betrachtung einbezieht, was dann wieder insgesamt einem isoliertem System entsprechen würde. Ändert sich in einem geschlossenen System die innere Energie U, so muß sich die innere Energie der Umgebung um den gleichen Wert, jedoch mit gegenteiligem Vorzeichen, ändern. Erklärung der einzelnen Komponenten: 1. Die innere Energie U: Die innere Energie ist eine Energieform, die von den kleinsten Teilchen eines Stoffes, den Atomen bzw. den Molekülen gespeichert wird. Dies geschieht in Form von Bewegungs-, Rotations- und Schwingungsenergie. Die innere Energie U ist eine Zustandsgleichung, sie hängt nur von ihrem momentanen Zustand ab, nicht aber vom Weg auf dem er erreicht wurde. 2. Die Wärme Q: Es wurde lange nicht genau zwischen den beiden Begriffen Wärme und Temperatur unterschieden. In früheren Jahrhunderten wurde für beides der Begriff calor verwendet. Ein System kann bei Zufuhr von Arbeit genauso verändert werden, wie bei Zufuhr von Wärme. Rührt man z.B. Wasser, so erwärmt es sich. Das macht es auch, wenn es mit einem wärmeren Körper in Kontakt gebracht wird. Deswegen wurde vermutet, daß Wärme auch eine Energieform darstellt. Einer der ersten Wissenschaftler, der zwischen den beiden Größen unterschied war Joseph Black. Er zeigte u.a., daß Wärme eine extensive und Temperatur eine intensive Größe ist. Auch der Arzt Robert Mayer und der Brauer James Prescott Joule haben von 1840-1850 in dieser Richtung zahlreiche Versuche unternommen. Betrachtet man zwei Systeme zwischen denen ein Temperaturunterschied ist, so wird solange Energie (in Form von Wärme) von Kälteren zum Wärmeren übertragen, bis beide die gleiche Temperatur haben. Voraussetzung ist, daß die beiden Systeme miteinander im thermischen Kontakt stehen. Bei offenen Systemen kann Wärme allerdings auch durch Stofftransport von einem System zum anderen übertragen werden. 3. Die Arbeit W: Verschiebt eine Kraft Teilchen in ihrer Lage, dann verrichtet sie Arbeit. Diese Arbeit kann auch an einem System verrichtet werden. Es ist aber nicht so, daß die Arbeit dem System zugefügt wird, oder daß ein System Arbeit enthält. Arbeit ist kein Stoff. Arbeit ist eine Wegfunktion, da ihr Zahlenwert abhängig ist von dem Weg durch den er erreicht wird. Eine wirkende Kraft kann an einem System z.B. Volumenarbeit verrichten. Betrachtet wird ein Gas, in dem Fall Wasserstoff (H2), das in einem Glaszylinder mit einer beweglichen Scheibe, der die Fläche A hat, eingeschlossen ist: Das Gas erfährt einen Druck, der sich aus der Gewichtskraft F der Scheibe und deren Fläche A berechnet:
Die Kraft F kann verstärkt werden, indem man die Scheibe z.B. mit Gewichten belegt. Steht das System im Gleichgewicht, ist die Scheibe in Ruhe. Der Druck des eingeschlossenen Gases ist in dem Fall genauso groß, wie der Druck von außen: Erhöht man den Druck von außen mit einem Gewichtsstück von 500 g, bewegt sich die Scheibe nach unten und komprimiert den Wasserstoff : Dies passiert solange, bis wieder ein Gleichgewicht zwischen dem neuen größeren Druck und dem Gegendruck des komprimierten Wasserstoffs besteht. Durch die Bewegung der Scheibe wird am Wasserstoff Arbeit W verrichtet:
p ist der Druck und DV ist die Volumenänderung des Gases. Man errechnet die Volumenänderung DV, indem man die Fläche A des Kolbens mit der Höhenänderung Dh des eingeschlossenen Gasvolumens multipliziert:
Dh bestimmt sich wie folgt: Das Volumen wird kleiner, wenn sich der Kolben um eine Strecke Dh bewegt. Daraus folgt, daß bei positivem Dh die Volumenänderung negativ ist. Die verrichtete Arbeit ist auch positiv, da das Gas komprimiert wurde. Perpetuum mobile: Eine Maschine, die Energie aus Nichts produziert, d.h. Energie liefert, ohne daß ihr eine gleiche Menge zugeführt wird, nennt man „Perpetuum mobile der 1. Art". Aus der Aussage des 1. Hauptsatzes wird klar, daß es eine solche Maschine nicht geben kann. Man müßte einen Energiegewinn nur aus einer Energieumverteilung erhalten. Somit müßte D U > 0 sein. Das widerspricht aber dem 1. Haupsatz, der folgendes aussagt: Wobei A und B Bezeichnungen für 2 verschiedene Zustände und s und u Abkürzungen für System bzw. Umgebung. Auch das erfolglose Bemühen zahlreicher Forscher und Tüftler bestätigt die Nicht-Existenz einer solchen Maschine. Zusammenhang mit der Enthalpie H: Führt man eine Reaktion bei konstantem Druck so durch, daß nur Volumenarbeit geleistet werden kann, dann gilt für die Arbeit W (Formel (27)):
mit p = Druck und DV = Volumenänderung Setzt man das in den 1. Hauptsatz ein, bekommt man folgendes:
umgestellt erhält man:
In diesem Fall nennt man Q Enthalpie H :
Die Enthalpieänderung DH ist definiert als diejenige Wärmemenge, die von einem geschlossenen isobaren System aufgenommen wird, wenn es eine Zustandsänderung erfährt, bei der außer Volumenarbeit keine andere Arbeit auftritt. Wird dabei Wärme an die Umgebung abgegeben, so nimmt die Enthalpie des Systems ab (DH ist negativ), und die Reaktion ist exotherm. Wärmeaufnahme bedeutet, daß es sich um eine endotherme Reaktion handelt (DH positiv). Bei einer Reaktion kann man das Vorzeichen und den Zahlenwert von DH fast nur den Energieänderungen zuschreiben, die mit dem Schließen, Aufbrechen bzw. Zusammenschliessen von chemischen Verbindungen zusammenhängen. |
| IV. Die Hauptsätze der Thermodynamik |
|
= Entropiesatz der Thermodynamik |
|
Der 1.
Hauptsatz setzt durch die Energieerhaltung
Grenzen, innerhalb derer ein Prozeß ablaufen
muß. Es gibt jedoch Prozesse, die den Energieerhaltungssatz
nicht verletzen würden, aber in der Natur nicht vorkommen.
Bringt man z.B. eine 300K warme Kugel in ein Gefäß mit 275K
kaltem Wasser, so fließt solange Wärme zum
Wasser, bis beide die gleiche Temperatur haben:
Es ist aber noch nie passiert, daß Wärme vom Kälteren zum Wärmeren fließt, was den Temperaturunterschied noch vergrößern würde. Die 300K warme Kugel wird nicht auf 400K aufgeheizt, während das Wasser auf 175 abkühlen müßte: Als weiteres Beispiel kann man eine Teigkugel betrachten, die auf ein Brett fällt: Durch den Aufprall erwärmt sich die Kugel (von 293 K auf 298 K). Es ist aber noch nie passiert, daß eine Teigkugel unter Abkühlung plötzlich nach oben springt: Das würde aber nicht dem 1. Hauptsatz widersprechen, da dieser nur aussagt, daß die Summe der Energien immer gleich sein muß, und das wäre sie bei einem solchen Vorgang. Um eine Aussage machen zu können, in welche Richtung ein Vorgang abläuft, wird eine Gleichung benötigt, die sich nur auf den Anfangszustand eines Systems und den darauf ausgeübten Zwang bezieht. Isolierte Systeme streben immer dem Gleichgewicht zu. Dabei muss eine Größe die Antriebskraft sein. 1850 wurde sie von Clausius die Entropie S genannt. Der 1. Hauptsatz beschreibt die Energiefunktion U und der 2. die Entropiefunktion. Genauso wie die innere Energie U ist auch der 2. Hauptsatz eine Zustandsfunktion. Die Gesamtentropie in einem isolierten System kann nie kleiner werden, d.h. sie kann nur größer werden oder gleich bleiben. Ein System kann sich nicht mehr verändern, wenn die Entropie ihren Maximalwert erreicht hat, das System befindet dann sich im Gleichgewicht. In einem geschlossenen System das im Gleichgewicht steht gilt: Solch eine Reaktion muß unter totaler Reversibilität ablaufen. Totale Reversibilität heißt, daß die Reaktion unendlich langsam verlaufen muß, damit immer überall gleiche Temperatur und Drücke herrschen. Beispielsweise wirbeln Gasmoleküle in einem Gas, das expandiert wird, durcheinander und bilden Turbulenzen, sodaß die exakte Umkehr dieses Prozesses unmöglich ist. Expandiert man dagegen unendlich langsam, sodaß sich keine Turbulenzen o.ä. bilden, dann ist die Umkehr schon eher möglich. Daran kann man sehen, daß eine reversible Reaktion einen Idealfall darstellt, der zwar manchmal fast erreicht wird, aber in der Realität nie ganz erreicht werden kann. Theoretisch wird die Reverisbilität jedoch behandelt. Man sagt, daß in einem geschlossenen System, in dem die Temperatur und der Druck gleich bleiben, ein spontaner reversibler Ablauf folgende Entropieänderung hat: Bei der Temperatur T nimmt das System die Wärmemenge Qrev. (=Wärmemenge bei reversiblem Prozeß) auf. Daraus folgt, daß die Entropieänderung der Umgebung sich wie folgt definiert: Alle Vorgänge können entweder als reversibel oder als irreversibel eingeordnet werden. Irreversibel bedeutet, daß der genaue Ablauf des Prozesses nicht mehr exakt umkehrbar ist. Bei diesen Vorgängen muß die Entropie immer zunehmen, deswegen ist ihre Änderung wie folgt definiert : In einem geschlossenen System muß die Summe der Entropien des Systems und der Umgebung kleiner als 0 sein: Der 2. Hauptsatz beschreibt die Richtung der Energieumwandlung. Wenn man z. B. einen fest verschlossenen Behälter betrachtet, in dem zwei Gase eingeschlossen sind, dann werden sich diese Gase mit der Zeit gleichmäßig durchmischen, d.h. einen Zustand größerer Unordnung und damit größerer Entropie einnehmen. Der Zustand größerer Entropie ist also der wahrscheinlichere Zustand. Aus dem 2. Hauptsatz folgt, daß Wärme nicht von einem Bereich mit niedriger Temperatur in einen Bereich mit höherer Temperatur übertragen werden kann, wenn keine Arbeit verrichtet wird. Perpetuum mobile: Der 2. Hauptsatz hat noch eine Bedeutung für die Thermodynamik. Eine Maschine, die unter Verletzung des 2. Hauptsatzes Arbeit verrichten würde, wird „Perpetuum mobile der 2. Art" genannt. Das wäre z.B. eine Wärmekraftmaschine, die Wärme aus einer kalten Umgebung entnehmen könnte, um in einer warmen Umgebung Arbeit zu verrichten. Laut dem 2.Hauptsatz ist dies aber unmöglich. Eine Maschine, die z.B. das Wärmereservoir der Meere in Arbeit umwandelt kann also nicht existieren. Von Planck kam der Vorschlag diese Tatsache "das Verbot des Perpetuum moblie 2.Art" zu nennen. Geschichtliche Zitate: Der Wissenschaflter Sir Kelvin formulierte: "Es ist unmöglich, eine zyklisch arbeitende Maschine zu konstruieren, die keinen anderen Effekt hat, als die Entnahme von Wärme aus einem Behälter und die Verrichtung eines gleichen Betrages an Arbeit." R.J.E. Clausius, 1854, Satz von der Vermehrung der Entropie: "Bei jedem natürlichen Vorgang nimmt die Entropie zu." Außerdem stammt von ihm: "Es ist nicht möglich eine zyklisch arbeitende Maschine zu konstruieren, die keinen anderen Effekt produziert als die Übertragung von Wärme von einem kälteren auf einen wärmeren Körper." und seine Zusammenfassung des 1. und 2. Hauptsatzes: "Die Energie des Universums ist konstant, die Entropie des Universums strebt immer einem Maximum zu, der 1. Hauptsatz ist Energieerhaltungssatz und deshalb ein Symmetriegesetz. Der 2. ist kein Symmetriegesetz und er drückt ein Prinzip aus, das die Symmetrie des Weltalls sprengt, indem es eine bestimmte Richtung seiner Veränderung fordert." |
| IV. Die Hauptsätze der Thermodynamik |
|
= Nernstsches Wärmetheorem |
Der 3. Hauptsatz wurde 1906 von Walter
Nernst aufgestellt. Er entdeckte ihn,
während er Entropien in
der Nähe des absoluten
Nullpunkts untersuchte. Da in einem
perfekten Kristall am absoluten Nullpunkt keine Teilchen
mehr schwingen können, kann es auch keine Entropieänderungen
mehr geben. Dies gilt aber nur für perfekte Einkristalle,
die unendlich ausgedehnt sind. Sobald die Gitterstruktur
einen Fehler aufweist, oder eine Bruchstelle hat, gibt es
wieder Unregelmäßigkeiten da nichtmehr jedes Teilchen exakt
die gleiche Umgebung besitzt. Teilchen 1 hat z.B. eine
andere Umgebung als Teilchen 2:
Daraus folgt, daß es Orte mit höherer Entropie, da die Unordnung dort größer ist und solche mit niedriger Entropie gibt. Teilchen 2 z.B. hat mehr Schwingungsmöglichkeiten als Teilchen 1: Der perfekte Kristall ist nur ein theoretischer Zustand, denn ein Stoff friert sehr oft gerade so ein, wie er im Flüssigen durchgemischt vorliegt. Außerdem ist es nicht wirklich möglich einen Kristall zu erhalten, der unendlich ausgedehnt ist und keinerlei Fehler aufweist. Also kann die Entropie nie wirklich Null sein. Der Grenzwert der Entropie bei der absoluten Temperatur von 0 K ist für jeden Reinstoff mit perfekter Kristallstruktur : In Worten ausgedrückt bedeutet dies: Es ist unmöglich durch irgendeinen Prozeß mit einer endlichen Zahl von Einzelschritten, die Temperatur eines Systems auf den absoluten Nullpunkt von 0 K (=Kelvin) zu senken (bisher tiefste erreichte Temperatur = 2*10-5K). Durch dieses Gesetz kann man allerdings nicht den absoluten Entropiewert am Nullpunkt sagen, nur, daß die Änderung Null ist. 1912 wurde jedoch von Max Planck vorgeschlagen willkürlich der Entropie am absoluten Nullpunkt den Wert Null zuzuteilen. Dadurch wurde es möglich, Entropien an anderen Punkten zu messen, wenn man als Bezugszustand den absoluten Nullpunkt wählt. Der 2. Hauptsatz sieht die Existenz einer absoluten Temperaturskala einschließlich eines absoluten Temperaturnullpunkts vor. Der 3. Hauptsatz der Thermodynamik besagt, daß der absolute Nullpunkt der Temperatur durch keinen Prozeß mit einer begrenzten Anzahl von Schritten erreicht werden kann. Man kann sich dem absoluten Nullpunkt beliebig nähern, ihn aber nie erreichen. Zitate von Wissenschaftlern: Planck: "Am absoluten Nullpunkt verschwinden die Entropien aller in einem inneren Gleichgewichtszustand befindlichen reinen Stoffe". G.N.Lewis und M.Randall (1923 in thermodynamics and the free energy of chemical substances): "Wenn man die Entopie der Elemente in irgendeinem kristallinen Zustand beim absoluten Nullpunkt der Temperatur gleich Null setzt, dann hat jeder Stoff eine bestimmte positive Entropie. Am absoluten Nullpunkt der Temperatur kann die Entropie den Wert 0 annehmen, sie tut dies bei völlig geordneten, perfekten Kristallen" |
Kurze Zusammenfassung der Hauptsätze[Bearbeiten | Quelltext bearbeiten]
- Nullter Hauptsatz der Thermodynamik: Einführung der Temperatur als physikalische Grundgröße: Stehen zwei Systeme jeweils mit einem dritten im thermodynamischen Gleichgewicht, so stehen sie auch untereinander im Gleichgewicht. Diejenige Zustandsgröße, die bei diesen Systemen übereinstimmt, ist die Temperatur.[27]
- Erster Hauptsatz der Thermodynamik: Die Energie eines abgeschlossenen Systems ist konstant.
- Zweiter Hauptsatz der Thermodynamik: Thermische Energie ist nicht in beliebigem Maße in andere Energiearten umwandelbar.
- Dritter Hauptsatz der Thermodynamik (Nernst-Theorem): Der absolute Nullpunkt der Temperatur ist unerreichbar.
Nullter Hauptsatz[Bearbeiten | Quelltext bearbeiten]
Wenn ein System A sich mit einem System B sowie B sich mit einem System C im thermischen Gleichgewicht befindet, so befindet sich auch A mit C im thermischen Gleichgewicht. Die Zustandsgröße, die bei diesen Systemen übereinstimmt, ist die Temperatur, die skalar, intensiv und überall im System gleich ist.
Anders formuliert: ist das Gleichgewicht transitiv, so haben zwei in Kontakt stehende Systeme genau dann die gleiche Temperatur, wenn sie sich im thermischen Gleichgewicht befinden, d. h. wenn zwischen ihnen keine Wärme (mehr) ausgetauscht wird.
Beispiel: Ein Thermometer ist selbst ein System und soll als B bezeichnet werden. Wenn B die gleiche Temperatur für ein System A, wie auch für ein System C anzeigt, lässt sich daraus schließen, dass auch A und C untereinander im thermischen Gleichgewicht stehen werden, wenn man sie in Kontakt bringt. Dieser Hauptsatz wurde erst nach den drei anderen Hauptsätzen formuliert. Da er aber ein Fundament der Thermodynamik bildet, wurde er später als „nullter“ Hauptsatz bezeichnet.
Allerdings ist im Gravitationsfeld zu beachten, dass das Gleichgewicht bei im Allgemeinen verschiedenen Temperaturen zwischen den Systemen A, B und C liegt, denn die Photonen der Schwarzkörperstrahlung erfahren im Gravitationsfeld aufgrund des Äquivalenzprinzips eine Rot- bzw. Blauverschiebung; durch die Zeitdilatation werden sie in unterschiedlichen Höhen mit verschiedenen Raten emittiert. Zudem sind deren Flugbahnen gekrümmt, so dass nicht alle von unten startenden Photonen auch oben ankommen können. All diese Effekte bewirken eine mit der Höhe abnehmende Temperatur. Auf der Erde beträgt dieser Effekt aber nur 1,6·10−14 K/m und ist daher unmessbar klein. Bei einem Neutronenstern ist er aber nicht vernachlässigbar.
Erster Hauptsatz[Bearbeiten | Quelltext bearbeiten]
Der 1. Hauptsatz der Thermodynamik beschreibt die Energieerhaltung in thermodynamischen Systemen. Er sagt aus, dass die Energie eines abgeschlossenen Systems konstant ist. Ausgehend von dieser Aussage lassen sich Energiebilanzen für geschlossene und offene Systeme bilden.
Bilanz für das geschlossene thermodynamische System[Bearbeiten | Quelltext bearbeiten]
Jedes System besitzt eine innere Energie (= extensive Zustandsgröße). Diese kann sich nur durch den Transport von Energie in Form von Arbeit und/oder Wärme über die Grenze des Systems ändern, das heißt:
Dabei ist die infinitesimale Änderung der an dem System geleisteten Arbeit (genauer: die Summe aus der Volumenarbeit und der im System dissipierten Arbeit, z. B. Reibungsarbeit), kennzeichnet inexakte Differentiale, während vollständige Differentiale kennzeichnet. Anstelle der Volumenarbeit können äquivalente extensive Arbeitsausdrücke verwendet werden. So wird beispielsweise für ein magnetisches System in einem Magnetfeld bei Erhöhung des magnetischen Momentes der Probe die extensive Arbeit geleistet.
Die Gleichung gilt für das ruhende System. Beim bewegten System kommen die äußeren Energien (potentielle und kinetische Energie) hinzu:
Die Energie eines abgeschlossenen Systems bleibt unverändert. Verschiedene Energieformen können sich demnach ineinander umwandeln, aber Energie kann weder aus dem Nichts erzeugt noch kann sie vernichtet werden. Deshalb ist ein Perpetuum mobile erster Art unmöglich (kein System verrichtet Arbeit ohne Zufuhr einer anderen Energieform und/oder ohne Verringerung seiner inneren Energie).
Eine Einschränkung der Umwandelbarkeit von Wärme in Arbeit ergibt sich erst aus dem zweiten Hauptsatz der Thermodynamik.
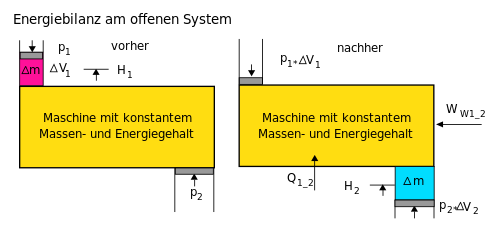
Energiebilanz für ein beliebiges offenes System[Bearbeiten | Quelltext bearbeiten]
Auf das offene System angewendet, wird der erste Hauptsatz mathematisch
anders formuliert.[28]
Beim offenen System fließen über die bestimmte Systemgrenze zusätzlich
zur mechanischen Arbeit an der verschiebbaren Systemgrenze
(Volumenänderungsarbeit z. B. am Kolben in einem Zylinder) die Verschiebearbeiten der
Massenströme am Ein- und Austritt. Sie sind das Produkt aus Druck und
Volumen. Statt mit der inneren Energie wird beim offenen System deshalb
mit den Enthalpien bilanziert,
die diesen Term enthalten.
Die Bilanz für ein instationäres System, bei dem sowohl Masseinhalt als auch Energieinhalt sich zeitlich ändern, lautet:
Dabei sind:
- : die zeitliche Änderung des Energieinhalts im System (Energieinhalt = innere Energie + kinetische Energie + potentielle Energie).
- : der Wärmestrom über die Systemgrenze.
- : der Arbeitsstrom (technische Arbeit) über die Systemgrenze.
- : der Massenstrom in das System.
- : der Massenstrom aus dem System
- : die spezifische Enthalpie
- : die spezifische potentielle Energie (mit = Höhe über dem Bezugsniveau und = Schwerebeschleunigung)
- : die spezifische kinetische Energie (mit = Geschwindigkeit).
Energiebilanz für einen stationären Zustand[Bearbeiten | Quelltext bearbeiten]
- Für einen stationären Zustand gilt: und
-
-
oder, fasst man die äußeren Energien in einem einzelnen Term
zusammen:
- zusätzlich adiabat (z. B. Dampfturbine):
Dabei ist die Wellenleistung der Maschine. Da vom System abgegebene Energien in der Thermodynamik negativ definiert sind, wird die Leistung einer Turbine aus dieser Gleichung negativ. In der Praxis wird das Vorzeichen deshalb gewechselt. In vereinfachten Berechnungen vernachlässigt man auch die äußeren Energien.
Energiebilanz für Kreisprozesse[Bearbeiten | Quelltext bearbeiten]
Da nach dem Durchlaufen eines Kreisprozesses das Arbeitsmedium zum Ausgangszustand zurückkehrt, vereinfacht sich die Bilanz, es entfallen die Änderungen der Zustandsgrößen, und es verbleiben die Prozessgrößen Wärme und Arbeit. Wie noch im Zusammenhang mit dem 2. Hauptsatz erläutert wird, kann nicht nur Wärme zugeführt werden, die komplett in Arbeit umgewandelt wird, sondern es muss auch Wärme abgeführt werden. Die einfache Bilanzgleichung lautet:
Dabei summiert das Kreisintegral alle Wärmeströme auf. Sie sind positiv, wenn sie in das System eintreten und negativ, wenn sie es verlassen. ist die gesamte Arbeit des Zyklus. Sie ist negativ, wenn sie abgegeben wird.
Die Beziehung wird auch oft mit den Wärmebeträgen geschrieben:
- ,
wobei die Wärmeabfuhr deutlicher erkennbar wird.
Zweiter Hauptsatz[Bearbeiten | Quelltext bearbeiten]
Der Zweite Hauptsatz der Thermodynamik trifft Aussagen über die Richtung von Prozessen und das Prinzip der Irreversibilität. Aus dem Zweiten Hauptsatz lassen sich die Definition der thermodynamischen Temperatur und die Zustandsgröße Entropie herleiten. Ebenso folgt aus dem Zweiten Hauptsatz der Thermodynamik die Unterscheidung von Exergie und Anergie und die Tatsache, dass der Wirkungsgrad einer Wärmekraftmaschine den Carnot-Wirkungsgrad nicht überschreiten kann.
Der zweite Hauptsatz der Thermodynamik in der Formulierung von Clausius lautet:
- „Es gibt keine Zustandsänderung, deren einziges Ergebnis die Übertragung von Wärme von einem Körper niederer auf einen Körper höherer Temperatur ist.“
Einfacher ausgedrückt: Wärme kann nicht von selbst von einem Körper niedriger Temperatur auf einen Körper höherer Temperatur übergehen. Diese Aussage scheint zunächst überflüssig zu sein, denn sie entspricht der alltäglichen Erfahrung. Dennoch ist sie gleichbedeutend zu allen weiteren, weniger „selbstverständlichen“ Aussagen, denn alle Widersprüche zu den anderen Aussagen lassen sich auf einen Widerspruch zu dieser zurückführen.
Der zweite Hauptsatz der Thermodynamik in der Formulierung von Kelvin und Planck lautet:
- „Es ist unmöglich, eine periodisch arbeitende Maschine zu konstruieren, die weiter nichts bewirkt als Hebung einer Last und Abkühlung eines Wärmereservoirs.“[29]
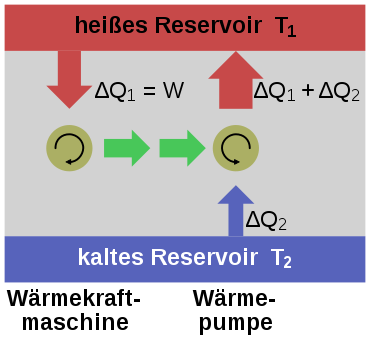
Dem ersten Hauptsatz würde die Annahme nicht widersprechen, dass es möglich sei, einer – wie immer auch gearteten – Kraftmaschine einen stetigen Wärmestrom zuzuführen, den diese vollständig als mechanische oder elektrische Leistung abgibt. Eine solche Maschine wird als Perpetuum mobile zweiter Art bezeichnet. Eine entsprechende Formulierung des zweiten Hauptsatzes lautet:
- Ein Perpetuum mobile zweiter Art ist unmöglich.
Nimmt man an, es gäbe diese von einer Wärmesenke zur Wärmeabfuhr unabhängige Kraftmaschine, so könnte damit der Umgebung, z. B. dem Meerwasser, Wärme entzogen und in mechanische Arbeit umgewandelt werden. Man könnte damit auch gemäß dem Bild rechts die Wärme aus einem Reservoir oder Behälter entziehen und mit der umgewandelten Energie eine Wärmepumpe antreiben, die mit einem reversiblen Carnot-Prozess Wärme aus einem anderen Behälter mit niedrigerer Temperatur in den Ersteren mit höherer Temperatur fördert. Die in den wärmeren Behälter eingespeiste Wärmemenge wäre dann größer als die von der Kraftmaschine aufgenommene, weil die abgegebene Energie der Wärmepumpe aus der Summe von aufgenommener Wärme und Antriebsarbeit besteht. Denkt man sich die Systemgrenze um beide Maschinen einschließlich der beiden Wärmebehälter gezogen, so wäre innerhalb dieses abgeschlossenen Systems – also ohne Energie- und Stoffaustausch mit der Umgebung – letztlich Wärme von einem kälteren zu einem wärmeren Körper geflossen. Dies ist ein Widerspruch zur ersten Aussage. Prinzipiell derselbe Widerspruch ergibt sich aber auch mit der Annahme, man könnte eine Kraftmaschine bauen, die einen größeren Wirkungsgrad aufweist als eine mit einem Carnot-Prozess arbeitende Maschine. Auch diese Maschine würde dem wärmeren Behälter weniger Wärme entnehmen als die von ihr angetriebene Carnot-Wärmepumpe dort einspeist. Die entsprechende Aussageform des zweiten Hauptsatzes lautet:
- Es gibt keine Wärmekraftmaschine, die bei gegebenen mittleren Temperaturen der Wärmezufuhr und Wärmeabfuhr einen höheren Wirkungsgrad hat als den aus diesen Temperaturen gebildeten Carnot-Wirkungsgrad
Die Nennung der mittleren Temperaturen ist deshalb von Bedeutung, weil in der Regel durch Wärmezufuhr oder Wärmeentnahme ein Wärmereservoir seine Temperatur ändert.
Dabei ist nicht irgendeine Temperatur (z. B. nicht die Grad Celsius- oder die Fahrenheit-Temperatur) des Systems, sondern die von der Zustandsgleichung des „idealen Gases“ her, oder besser durch den gerade angegebenen Wirkungsgrad des Carnot-Prozesses definierte „absolute Temperatur“ (Kelvin).
Unmittelbar in diesem Zusammenhang lässt sich weiter formulieren:
- Alle reversiblen Wärme-Kraft-Prozesse mit gleichen mittleren Temperaturen der Wärmezufuhr und Wärmeabfuhr haben denselben Wirkungsgrad wie der entsprechende Carnot-Prozess.
und:
- Alle irreversiblen Wärme-Kraft-Prozesse haben einen geringeren Wirkungsgrad.
Mit den in der modernen Thermodynamik festgelegten Begriffsdefinitionen (Wärme, Arbeit, Innere Energie, Zustandsgröße, Prozessgröße, adiabat…) und mit der systematischen Einteilung der Systeme kann über die von Clausius eingeführte Zustandsgröße Entropie eine für alle geschlossenen Systeme und Prozesse in offenen Systemen allgemein gültige Aussage des zweiten Hauptsatzes in mathematischer Form gegeben werden. Bei offenen Systemen bezieht sich die Bilanz auf ein Fluidteilchen, das sich durch das System hindurch bewegt und als geschlossenes bewegtes System betrachtet werden kann (siehe oben).
Dabei ist die innerhalb des Systems dissipierte Arbeit (Arbeit, die nicht nach außen gelangt, sondern infolge von Reibungs-, Drosselungs- oder Stoßvorgängen die innere Energie erhöht). Sie ist immer positiv. Man bezeichnet den entsprechenden Term in der Gleichung als „produzierte Entropie“ – im Gegensatz zum ersten Term, der „transportierte Entropie“ genannt wird und auch negativ sein kann.
Für das adiabate System mit ergibt sich daraus:
- In einem geschlossenen adiabaten System kann die Entropie nicht abnehmen, sie nimmt in der Regel zu. Nur bei reversiblen Prozessen bleibt sie konstant.
Auch hier ist die Äquivalenz mit der ersten Aussage von Clausius leicht zu erkennen. Ein selbsttätiger Wärmefluss vom kälteren zum wärmeren Behälter in der oben skizzierten Anordnung würde bedeuten, dass die Entropie des kälteren Behälters (geringere Temperatur im Nenner) stärker abnimmt, als die des wärmeren zunimmt, d. h. die gesamte Entropie im System abnimmt, was nicht möglich ist.
Alle spontan ablaufenden Prozesse sind irreversibel. Dort findet immer eine Entropiezunahme statt. Beispiele sind die Vermischung von zwei unterschiedlichen Gasen und der Wärmefluss von einem heißen zu einem kalten Körper ohne Gewinnung von Arbeit. Die Wiederherstellung des (oft „geordneter“ genannten) Anfangszustandes erfordert dann den Einsatz von Energie oder Information (siehe maxwellscher Dämon). Reversible Prozesse sind nicht mit einer Erhöhung der Gesamtentropie verbunden und laufen daher auch nicht spontan ab. Durch die theoretische Beschreibung spontan ablaufender Prozesse zeichnet der Zweite Hauptsatz der Thermodynamik eine Richtung der Zeit aus, die mit unserer intuitiven Erfahrungswelt übereinstimmt (vgl. das Beispiel weiter unten).
Mit den beschriebenen Zusammenhängen ist auch der folgende Satz eine Aussageform des zweiten Hauptsatzes:
- Die thermische Energie eines Systems besteht aus einem Anteil Exergie und einem Anteil Anergie, wobei der exergetische Anteil verschwindet, wenn das System in den Umgebungszustand übergeführt wird.
Die Exergie ist der in andere Energieformen umwandelbare Anteil der thermischen Energie. Wird ein Körper bzw. System mit einem Zustand, der von dem der Umgebung abweicht, reversibel in den Umgebungszustand gebracht, so wird seine Exergie als Arbeit abgegeben. Die Wärme, die ein Körper (z. B. ein heißes Rauchgas im Kessel eines Kraftwerks) abgibt, wenn es sich auf Umgebungstemperatur abkühlt, kann theoretisch über eine Folge von differenziellen Carnot-Prozessen, wie im Bild rechts dargestellt, zur Umwandlung in Arbeit genutzt werden. Der exergetische Anteil ergibt sich durch Aufsummieren der differenziellen (pinkfarbenen) Flächenanteile oberhalb der Umgebungstemperatur .
Die Wärmesenke für diese Prozesse zur Aufnahme der Anergie (blauer Flächenanteil unterhalb ) ist die Umgebung. Herrscht bei einem Gas im Ausgangszustand gegenüber dem Umgebungszustand nicht nur eine höhere Temperatur, sondern auch ein höherer Druck, so besteht die gesamte Exergie nicht nur aus dem exergetischen Anteil der Wärme, sondern zusätzlich aus einem Anteil Volumenarbeit.
Der thermische Wirkungsgrad der realen Wärmekraftmaschine ist also immer kleiner als 1 und – bedingt durch die von den Maschinen vorgegebene Prozessführung und die unvermeidlichen dissipativen Effekte – auch immer kleiner als der der idealen Wärmekraftmaschine:
wobei die Umgebungstemperatur ist und die mittlere Temperatur der Wärmezufuhr. Sie ergibt sich, wenn die gelbe Fläche der Exergie durch ein flächengleiches Rechteck oberhalb der Linie der Umgebungstemperatur ersetzt wird.
Der Zweite Hauptsatz hat somit erhebliche technische Auswirkungen. Da viele Maschinen, die mechanische Energie liefern, diese über einen Umweg aus thermischer Energie erzeugen (z. B. Dieselmotor: chemische Energie thermische Energie mechanische Energie), gelten für ihre Wirkungsgrade immer die Beschränkungen des 2. Hauptsatzes. Im Vergleich dazu bieten Wasserkraftanlagen, die bei der Umwandlung keine Zwischenstufe über thermische Energie benötigen, erheblich höhere Wirkungsgrade.
Dritter Hauptsatz[Bearbeiten | Quelltext bearbeiten]
Dieser Hauptsatz wurde von Walther Nernst im Jahr 1906 vorgeschlagen und ist auch als Nernst-Theorem bekannt. Er ist quantentheoretischer Natur und äquivalent zur Aussage von der Unerreichbarkeit des Nullpunktes der absoluten Temperatur:
- Es ist nicht möglich, ein System bis zum absoluten Nullpunkt abzukühlen.
Bei der Annäherung der Temperatur an den absoluten Nullpunkt () wird die Entropie unabhängig von thermodynamischen Parametern. Damit geht gegen einen festen Grenzwert :
Die konstante Entropie bei lässt sich als darstellen, wobei die Boltzmann-Konstante und die Anzahl der möglichen Mikrozustände im Grundzustand (Entartung) ist. Zum Beispiel würde sich für einen -atomigen Kristall, dessen Atome im Energiegrundzustand zwei mögliche Spineinstellungen haben, ergeben.
Für alle physikalisch-chemischen Reaktionen, bei denen die teilnehmenden Stoffe am absoluten Nullpunkt als ideale kristalline Festkörper vorliegen, gilt:
Es gibt nur eine Realisierungsmöglichkeit für ideale Festkörper am absoluten Nullpunkt, .
Die genannten Aussagen können mit Methoden der Quantenstatistik streng bewiesen werden.
Energieberechnungen in der Thermodynamik[Bearbeiten | Quelltext bearbeiten]
Die Energiebilanz hat in der Thermodynamik einen hohen Stellenwert.
Bei einer Phasenumwandlung (fest-flüssig-gasförmig) oder Mischungen (Salz in Wasser, Mischung verschiedener Lösungsmittel) werden Umwandlungsenergien (Schmelzenthalpie, Verdampfungsenthalpie, Sublimationsenthalpie) oder Umwandlungsenthalpien benötigt bzw. werden in umgekehrter Richtung frei. Bei einer chemischen Stoffumwandlung können Reaktionswärmen oder Reaktionsenthalpien frei werden oder müssen umgekehrt zugeführt werden.
Zur Berechnung von frei werdenden Reaktionswärmen bei Stoffumsetzungen wird zunächst die entsprechende Reaktionsgleichung mit den dazugehörigen stöchiometrischen Faktoren aufgestellt. Die Standardbildungsenthalpien der Einzelstoffe sind für 25 °C in Tabellenwerken verzeichnet. Man addiert die Summe der Enthalpien der Produkte entsprechend den stöchiometrischen Faktoren und zieht davon die Enthalpien der Ausgangsstoffe ab (Hess’scher Wärmesatz).
Die Reaktions- oder Umwandlungsenthalpie, die bei einer chemischen Umsetzung oder Phasenumwandlung an die Umgebung abgegeben wird, hat ein negatives Vorzeichen. Ist eine Energiezufuhr von der Umgebung für eine Phasenumwandlung oder eine chemische Umsetzung nötig, so hat diese ein positives Vorzeichen.
Die Zustandsgröße Enthalpie ist, ausführlich:
Die Freie Enthalpie ist
Durch Bildung des totalen Differentials der Freien Enthalpie und anschließende Integration lässt sich berechnen, ob eine chemische Umsetzung möglich ist.
Ist die Differenz der Freien Enthalpien der Produkte zu den Ausgangsstoffen (Edukte) negativ, ist eine Phasenumwandlung oder eine Stoffumsetzung möglich. Ist die Differenz der Freien Enthalpie einer Reaktion, einer Phasenumwandlung negativ, erfolgt eine Reaktion – soweit diese nicht kinetisch gehemmt ist – bis zu einem Punkt, an dem wird. Das Massenwirkungsgesetz ist ein Spezialfall eines solchen Gleichgewichtes. Ist die Differenz der Freien Enthalpie positiv, so ist eine Reaktion oder Phasenumwandlung unmöglich.
Im Jahr 1869 glaubte Marcellin Berthelot noch, dass nur chemische Umwandlungen möglich seien, bei denen Wärme frei wird. Mittlerweile sind Umwandlungen und Reaktionen bekannt, bei denen keine Reaktionswärme oder Umwandlungswärme frei wird. Dies liegt am Entropieterm
Beispiele:
- Bei Lösen von Glaubersalz in Wasser wird die Lösung kälter als die Umgebung. Der Enthalpieterm ist positiv, jedoch nimmt die Unordnung, d. h. die Entropie, durch die Auflösung zu.
- Beim Schmelzen eines Eisblockes wird Wärme zur Phasenumwandlung von fest zu flüssig benötigt. Die Temperatur des Wassers steigt nicht, obgleich Wärme von der Umgebung zugeführt wird. Die Unordnung, die Entropie der Moleküle ist im flüssigen Zustand größer als im festen Zustand.
- Bei der Umwandlung von Kohle und Kohlendioxid zu Kohlenmonoxid ist die Reaktionsenthalpie positiv. Durch die Reaktionsentropie lässt sich das Gleichgewicht (siehe: Boudouard-Gleichgewicht) bei hoher Temperatur zum Kohlenmonoxid verschieben.
Thermodynamik irreversibler Prozesse[Bearbeiten | Quelltext bearbeiten]
Neben der klassischen Gleichgewichtsthermodynamik wurde im 20. Jahrhundert die Nichtgleichgewichtsthermodynamik oder auch Thermodynamik irreversibler Prozesse entwickelt. Für diese Arbeiten wurden die Nobelpreise der Chemie im Jahr 1968 an Lars Onsager und 1977 an Ilya Prigogine verliehen.
Die klassische Thermodynamik macht über Nichtgleichgewichtsprozesse nur die qualitative Aussage, dass diese nicht umkehrbar sind, beschränkt sich aber in ihren quantitativen Aussagen auf Systeme, die stets global im Gleichgewicht sind bzw. nur inkrementell davon abweichen. Demgegenüber behandelt die Nichtgleichgewichtsthermodynamik Systeme, die sich nicht in einem globalen thermodynamischen Gleichgewicht befinden, sondern davon abweichen. Oft wird jedoch noch ein lokales thermodynamisches Gleichgewicht angenommen.
Ein wichtiges Ergebnis der Nichtgleichgewichtsthermodynamik ist das Prinzip der minimalen Entropieproduktion für offene Systeme, welche nur wenig vom thermodynamischen Gleichgewicht abweichen. Dies ist der Bereich der so genannten linearen irreversiblen Thermodynamik. Sie beschreibt in einem vereinheitlichten formalen Rahmen lineare Zusammenhänge zwischen Flüssen und ihren korrespondierenden Kräften. Diese Kräfte werden normalerweise als Gradienten einer skalaren Größe aufgefasst und die Flüsse durch bekannte lineare Naturgesetze beschrieben, wie zum Beispiel das ohmsche Gesetz (Stromfluss), das Ficksche Gesetz (Diffusion), das Fouriersche Gesetz (Wärmeleitung) oder die Kinetik einer chemischen Reaktion (Reaktionsgeschwindigkeit). Durch die Bilanzierung der Entropie, in die die Produktion der Entropie in dem System und die über die Systemgrenzen fließende Entropie eingehen, lässt sich durch den zweiten Hauptsatz die Invarianz dieser Gesetze zeigen. Für das Beispiel der Wärmeleitung zeigt sich, dass mit der Thermodynamik nur ein Wärmefluss vom heißen zum kalten vereinbar ist, und dass die Wärmeleitfähigkeit immer eine positive Größe sein muss. Durch die mathematische Analyse wird außerdem gezeigt, dass eine thermodynamische Kraft (z. B. Temperaturdifferenz oder Spannungsdifferenz) in einem System einen zusätzlichen indirekten Fluss verursacht (Beispiel: elektrischer Stromfluss verursacht durch Wärmeleitung (Seebeck-Koeffizient), oder Wärmestrom verursacht durch einen elektrischen Stromfluss (Peltier-Koeffizient)). Von Lars Onsager wurde gezeigt, dass die Einflüsse zwischen Flüssen und den nicht dazu korrespondierenden Kräften gleich groß sind (Reziprozitätsbeziehungen). Da die Entropiebilanz in einem geschlossenen System immer positiv sein muss, folgt zusätzlich: Die Größe der Kreuzeffekte ist immer wesentlich kleiner als die direkten Effekte. Für das Beispiel mit den zwei Kräften gilt, dass die Kreuzeffekte (Peltier-Koeffizient und Seebeck-Koeffizient) maximal zweimal der Wurzel aus den Produkten der Koeffizienten der beiden direkten Effekte (elektrische und thermische Leitfähigkeit) entspricht.
Weicht ein offenes System stark vom Gleichgewicht ab, kommt die nichtlineare Nichtgleichgewichtsthermodynamik zum Zug. Wichtiges Ergebnis in diesem Bereich ist das Stabilitätskriterium von Ilya Prigogine und Paul Glansdorff, das angibt, unter welchen Bedingungen der Zustand mit der minimalen Entropieproduktion instabil wird und ein System bei gleichzeitigem Entropieexport eine höher geordnete Struktur annehmen kann. In diesem Bereich können also spontan so genannte dissipative Strukturen entstehen, die experimentell bestätigt wurden (beispielsweise Bénard-Zellen). Da in diesem nichtlinearen Bereich auch biologische Prozesse anzusiedeln sind, ist dieses Resultat besonders auch in Hinsicht auf die Entwicklung des Lebens von großer Bedeutung.